图片来源:摄图网
随着减肥神药司美格鲁肽爆火,如何规范化监管成为了一个迫切需要解决的问题。近日,国家药品监督管理局药品审评中心(CDE)公开发布了《司美格鲁肽注射液生物类似药体重管理适应证临床试验设计指导原则(征求意见稿)》。指导原则明确,司美格鲁肽注射液生物类似药应以在我国上市的诺和诺德的原研药为参照药,开展药代动力学比对试验和临床安全有效性比对试验,以支持按生物类似药注册上市。
在此背景下,杭州九源基因工程股份有限公司(简称九源基因)递交的司美格鲁肽注射液吉优泰上市申请获得受理,其成为国内首个申报上市的司美格鲁肽生物类似药,适应症为用于成人2型糖尿病患者的血糖控制,这也标志着国内司美格鲁肽商业化比拼拉开序幕。
在国际上,以诺和诺德的司美格鲁肽为代表的GLP-1类药物早已获批上市,诺和诺德因此早已赚的盆满钵满。而在国内司美格鲁肽的减重适应症尚未获批。目前,国产药企司美格鲁肽进入三期临床阶段的就有九源基因、华东医药、九源基因、博唯生物等企业,要将国产司美格鲁肽用于减重仍尚需时日。
随着市场竞争日趋激烈,有券商医药行业分析师表示,在GLP-1的研发布局层面,时间壁垒、药物的差异化设计,以及卓越的药物疗效是成功的关键。同样的产品如果临床进度更快,商业化更早,将在院端市场具有较大的先发优势。同时,从过去的销售数据也能看出,长效的GLP-1制剂市场份额在不断攀升。
从国内首款生物类似药申请上市回看我国生物类似药行业发展情况:
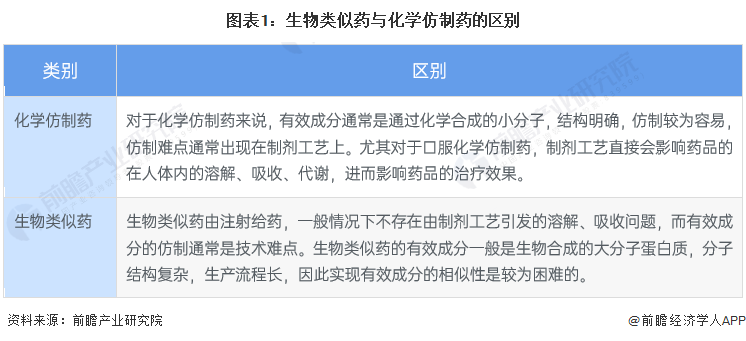
——生物类似药的本质是仿制药,生物类似药结构复杂仿制困难
根据国家药品监督管理局发布的《生物类似药研发与评价技术指导原则(试行)》中的定义,生物类似药是在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。生物类似药是对原研药的仿制,在原研药专利保护到期之后,生物类似药方可获得审批。由于生物类似药可以更好地满足公众对生物治疗产品的需求,有助于提高生物药的可及性和降低价格,许多国家都十分重视生物类似药的研发和管理工作。
——已有30多个生物类似药获得批准上市
截至2023年9月8日,中国已有30多个生物类似药获得批准上市。从已批准的生物类似药参照药品来看,贝伐珠单抗是热度最高的参照药品,现国内已有10家生物类似药批准上市;其次是阿达木单抗,已有7家生物类似药批准上市。

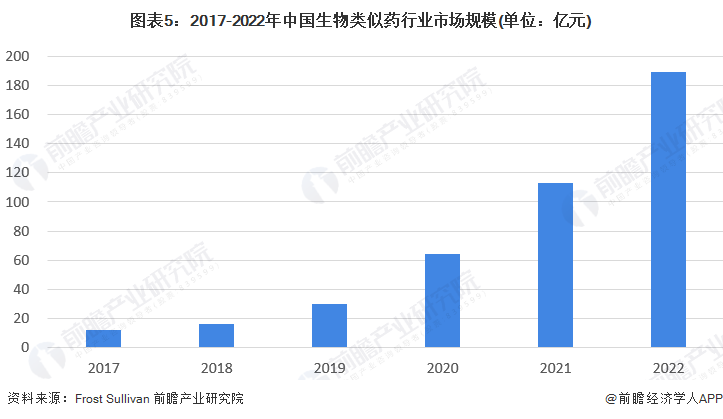
——中国生物类似药行业市场规模
价格过高是原研药在国内渗透率较低的主要原因,生物类似药研发成本较原研药更低,因此更具价格优势。根据Frost & Sullivan报告数据显示,2018年中国生物类似药行业市场规模约为16亿元,到2022年约为189亿元,2018-2022年年均复合增长率约为85.39%。
产业研究院分析认为,政府的政策支持和资金投入,以及科研实力的不断提升,为生物类似药研发提供了坚实基础。巨大的市场潜力、国际竞争力的增强和技术突破,将推动生物类似药在中国及全球市场的崭露头角。到2028年,中国生物类似药行业市场规模或将达到522亿元,市场前景广阔,2023-2028年年均复合增长率约为15.05%。
经济学人APP资讯组
看完觉得写得好的,不防打赏一元,以支持蓝海情报网揭秘更多好的项目。